Отрасль знания / тема, в которой «пересекаются» учебные предметы: компьютерное моделирование химических процессов.
Карту триместрового экзамена можно загрузить отсюда.
“Портабельная” версия программы Chem & Bio Office 2008 находится здесь.
Руководства пользователя (на английском языке):
Краткая инструкция по работе в ChemOffice (на русском языке, но рассматривается предыдущая версия программы).
Дискуссионные вопросы к триместровому экзамену найдете здесь
Ира — хлорирование метана, V(CH4) = 44,8 л
Таня — бромирование пропана, V(Br2) = 500 мл
Алена — окисление метана, V(CH4) = 22,4 л
Лиля — реакция Вюрца с хлорметаном, m(хлорметана) = 136 г
Маричка — реакция Вюрца с хлорэтаном, m(хлорэтана) = 100 г
Радион — окисление этана, V(этана) = 56 л
Даниэлла — хлорирование пропана, V(пропана) = 56,2 л
Даша — бромирование 2-метилпропана, V(Br2) = 300 мл
Миша — окисление пропана, V(пропана) = 100 л
Давид — реакция Вюрца с 2-хлорпропаном, m(2-хлорпропана) = 96 г
Стас — реакция Вюрца с 2-бром-2-метилпропаном, m(2-бром-2-метилпропана) = 200 г
Антон — окисление пентана, V(пентана) = 1 л
Диниил — хлорирование бутана, V(бутана) = 72,6 л
Экзотермическая реакция – это реакция, которая проходит с выделением энергии.
Эндотермическая реакция – это реакция, которая проходит с поглощением энергии.
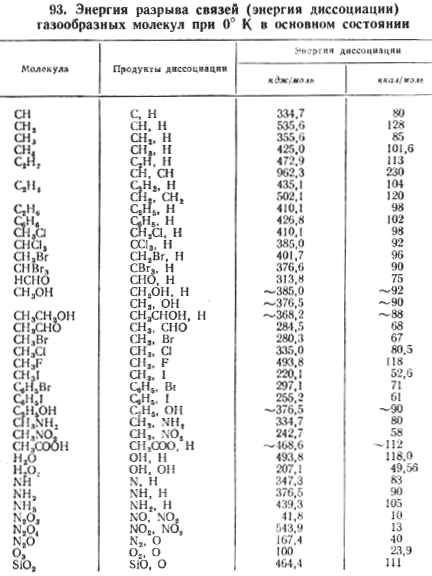
В результате химической реакции происходит разрыв старых химических связей и образование новых. При разрыве химической связи происходит поглощение энергии, а при образовании новой химической связи ее выделение.
Чтобы понять к какому типу реакций относится ваша реакция, необходимо просто посчитать разность этих энергий.
Например: Н2 + Сl2 = 2HCl
В результате реакции разрывается одна связь Н-Н и одна Сl-Cl и образуется две связи H-Cl
Заглянем в таблицу энергий диссоциаций связей:
Для связи Н-Н это 104
Для связи Сl-Cl это 58
Для связи H-Cl это 103
В итоге получаем -104 + (-58) = -162 это энергия, которая затрачивается (со знаком минус)
(+103) × 2= +206 – это энергия, которая выделяется (со знаком плюс)
Считаем разницу: +206 – 162= +44 – т.е. в результате этой реакции энергия выделяется.
Br-Br – 46
CH3–H … (C-H, т.е. первичный атом углерода) – 104
(CH3)2CH-H … (C-H, т.е. вторичный атом углерода) – 94
(CH3)3C-H … (C-H, т.е. третичный атом углерода) – 91
H-Br – 88
HO-H – 120
Напоминаю, что энергия образования связи равняется энергии разрыва (диссоциации) связи.